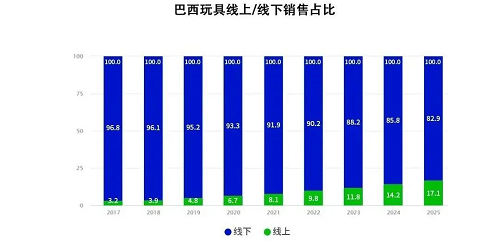
2023年6月9日,九芝堂美科(北京)细胞技术有限公司(以下简称“九芝堂美科”)所提交的“人骨髓间充质干细胞注射液”新药临床试验申请(IND)获国家药品监督管理局默示许可(受理号:CXSL2300202),适应症为自身免疫性肺泡蛋白沉积症(aPAP)。这是国内首次使用干细胞治疗自身免疫性肺泡蛋白沉积症(aPAP)的临床试验申请,有望为自身免疫性肺泡蛋白沉积症(aPAP)患者带来新希望。

药品基本信息 药品名称:人骨髓间充质干细胞注射液 适应症:自身免疫性肺泡蛋白沉积症(aPAP) 注册分类:治疗用生物制品 1 类 申请事项:境内生产药品注册临床试验 申请人:九芝堂美科(北京)细胞技术有限公司 受理号:CXSL2300202 人骨髓间充质干细胞注射液是九芝堂美科自主研发的冷冻保存型干细胞制剂,源自健康年轻成人供者骨髓,全程在模拟人体真实生理环境——低氧条件下培养,临床拟用于治疗自身免疫性肺泡蛋白沉积症(aPAP)。 肺泡蛋白沉积症(PAP)是一种以肺泡表面活性物质在肺泡巨噬细胞和肺泡腔内异常沉积导致呼吸困难为主要特征的弥漫性肺疾病,主要包括自身免疫性、遗传性或先天性和继发性,其中自身免疫性肺泡蛋白沉积症(aPAP)最为常见,占 PAP 患者的90%。临床表现多样,可从无明显临床症状到危及生命的严重呼吸衰竭不等。 目前肺泡蛋白沉积症(PAP)的标准治疗为全肺灌洗术,即通过机械性冲洗,去除积聚于肺泡腔内的磷脂物质,使肺泡功能得以恢复。但该程序技术治疗有益却不能治愈,具有高侵入性,并且可能发生不可预见的并发症。目前尚无批准的用于治疗自身免疫性肺泡蛋白沉积症(aPAP)的药物,研发安全有效的治疗药物,是当前未被满足的临床需求。 作为一家专注于干细胞药物研发的国家高新技术企业,九芝堂美科是由百年药企九芝堂股份有限公司(股票代码 sz000989)发起的雍和启航基金投资设立,目前已在“中国药谷”北京大兴生物医药基地建成符合中国、美国和欧盟 GMP 标准的大规模干细胞研发生产基地,办公生产面积约 4800 m²,生产平台设有 4 个独立 B+A 洁净区,可生产符合中、美药品申报要求的临床级干细胞。 基于其世界先进的干细胞制备工艺与完善的质量管理体系,九芝堂美科已实现了临床级干细胞规范化、规模化的生产制备,其生产的不同供者、不同批次的干细胞已通过中国食品药品检定研究院(简称“中检院”)全面质量检测,检测结果全部合格,还通过了中国医药生物技术协会关于“干细胞制剂制备质量管理自律规范”认证的现场检查,并荣获《干细胞制剂制备质量管理合格证书》,成为中国医药生物技术协会认证的干细胞制备公司。 经过多年深耕,九芝堂美科已经在干细胞制备工艺和质量管理体系等方面积累了丰富的实战经验,此次完成“人骨髓间充质干细胞注射液”新药临床试验申请(IND),更加体现了九芝堂美科不断加码在干细胞多条管线研发扩张的决心。我们有理由相信,九芝堂美科在干细胞产品“工艺与质量”的双轮驱动下,不仅能取得更多的干细胞临床研发成果,更能在日趋激烈的干细胞成药赛道中大放异彩。